
本文將CRISPR-Cas12a系統與MRS傳感相結合,構建基于CRISPR-Cas12a系統的MRS生物傳感器檢測沙門氏菌。充分利用MNPs作為磁分離工具和信號標簽的雙重功能,為生物傳感器的設計提供了新思路。同時,得益于CRISPR-Cas12a系統的高特異性和MRS檢測的高靈敏度,該生物傳感器對沙門氏菌具有良好的檢測性能。
構建基于CRISPR-Cas12a的MRS生物傳感器檢測沙門氏菌。引入小粒徑的MNPs作為磁信號探針,開發MNPs產生信號的新功能。該生物傳感器通過CRISPR-Cas12a系統在目標物存在下對biotin-S1的切割作用控制兩種不同粒徑MNPs的結合,然后利用大小粒徑MNPs磁分離速度的差異,以溶液中游離的小粒徑MNPs為信號輸出分子檢測沙門氏菌。得益于CRISPR-Cas12a系統的高特異性和高效切割活性以及MRS檢測方法的高靈敏度,該生物傳感器對純菌液和雞肉提取液加標樣品中沙門氏菌的LOD分別為1.3×102 CFU mL-1和1.8×103 CFU mL-1,且可避免重復磁分離與洗滌,操作更為簡便。
MNPs可作為MRS傳感檢測中的磁性探針。傳統的基于MNPs聚集/分散狀態改變的MRS生物傳感方法易受樣品基質干擾,穩定性較差。基于MNPs數量變化的MRS生物傳感器已經得到了較好的發展。但是以上方法需要目標物自身提供位點以控制大小粒徑MNPs之間的結合。目標物的表面位點有限且可能發生非特異性結合,因而檢測靈敏度會受到影響。為此,本文將CRISPR-Cas12a系統與MRS傳感技術相結合,利用CRISPR-Cas12a系統精準控制兩種不同粒徑MNPs之間的結合,開發基于CRISPR-Cas12a的MRS生物傳感器檢測沙門氏菌。
如圖1所示,分別在粒徑為130 nm和30 nm左右的MNP130和MNP30表面修飾SA和S2,制得SA修飾的MNP130(MNP130-SA)和S2修飾的MNP30(MNP30-S2)探針。當目標物存在時,Cas12a、crRNA和靶標DNA形成三元復合體,并激活trans切割活性以非特異性切割biotin-S1。因此,MNP30-S2無法通過S1和S2之間的堿基互補配對作用結合至MNP130-SA表面,在磁場作用下仍分散在溶液中。反之,大量MNP30-S2結合至MNP130-SA表面,并在磁場作用下被分離。最后,以清液中游離的MNP30-S2為探針,通過橫向弛豫時間T2的測定檢測沙門氏菌。
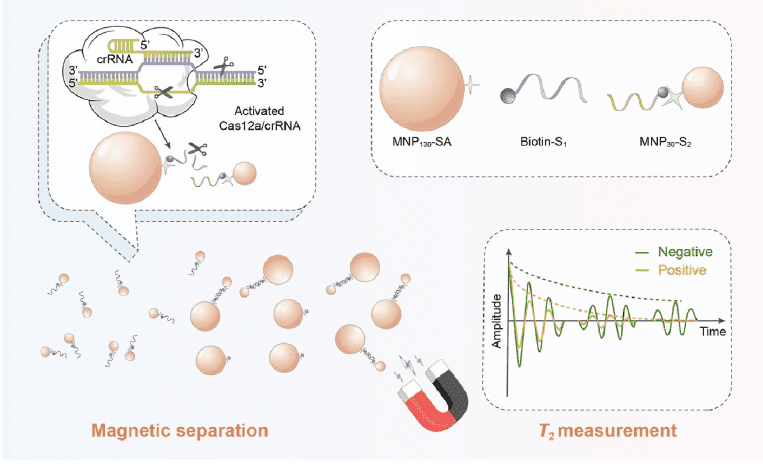
圖1
紐邁核磁助力:利用低場核磁設備(PQ001,紐邁電子科技有限公司,上海,中國)測量獲得樣品的橫向弛豫時間T2。在測定T2時,儀器的溫度精確設置為32±0.01°C。利用硬脈沖序列Q-FID校準儀器中心頻率O1及尋找90o射頻脈寬P1和180o脈寬P2。然后,利用Carr-Purcell-Meiboom-Gill(CPMG)脈沖序列進行T2的測量。
1:利用TEM表征MNP130-SA在有無目標物存在下的表面狀態。如圖2A所示,MNP130-SA的粒徑為130 nm左右;而MNP30-S2的粒徑在30 nm左右。在無目標物存在下,MNP130-SA捕獲biotin-S1,并與MNP30-S2結合,因此MNP130-SA表面結合了大量MNP30-S2。而當目標物存在下,Cas12a/crRNA復合體的trans切割活性被激活,使biotin-S1被非特異性切割,從而影響MNP130-SA與MNP30-S2之間的結合。因此MNP130-SA周圍僅有極少量MNP30-S2的存在。以上TEM表征結果證明了該生物傳感器檢測S. Typhimurium具備可行性。
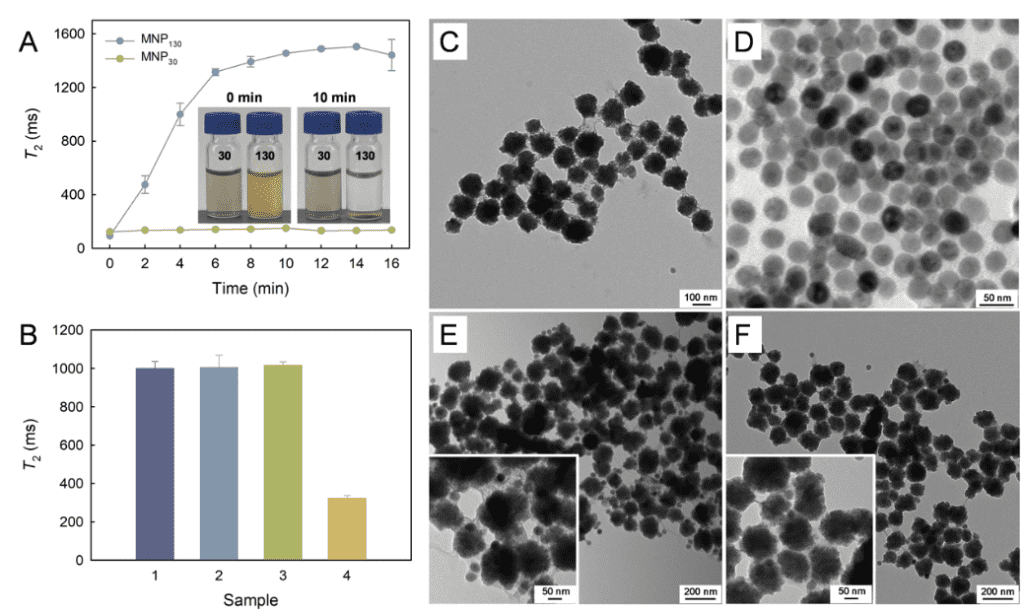
圖 2
2:考察切割方式對檢測效果的影響。即方案1:先將biotin-S1偶聯至MNP130-SA表面制得MNP130-S1,然后利用CRISPR-Cas12a系統切割MNP130表面的S1;方案2:切割溶液中游離的biotin-S1,然后加入MNP130-SA進行捕獲。采用方案1時,利用肉眼觀察分散性變化即可實現目標物的定性檢測,簡單方便,但是靈敏度較低;而采取方案2則可顯著提高MRS生物傳感器對目標物的響應。為提高檢測靈敏度,在后續實驗中繼續采取方案2的切割方式檢測沙門氏菌。
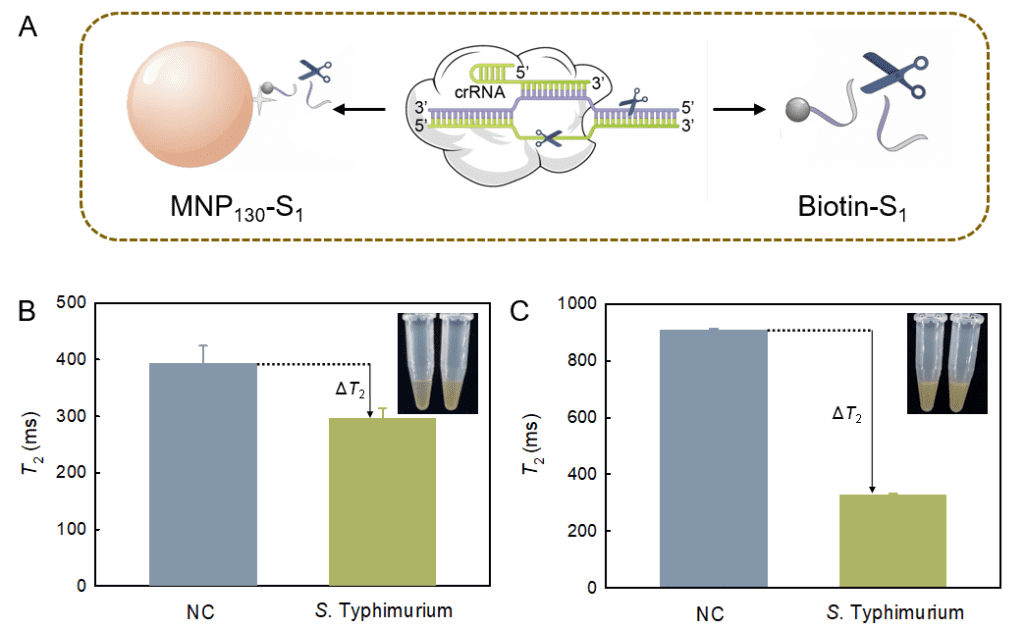
圖 3
3:從圖4可以看出,1.3×102 CFU mL-1細菌濃度下的T2值已低于閾值線,說明該方法可對1.3×102 CFU mL-1的S. Typhimurium進行檢測,其LOD明顯低于大部分已報道的MRS生物傳感器。對雞肉提取液加標樣品中的S. Typhimurium進行檢測。該方法對雞肉提取液中S. Typhimurium的LOD為1.8×103 CFU mL-1。將純菌液和雞肉提取液中的檢測結果進行對比發現,雞肉提取液中103 CFU mL-1細菌引起的信號響應明顯高于純菌液(ΔT2%分別為10%和47%)。為評估該生物傳感器對沙門氏菌的特異性,選取S. aureus、E. coli O157:H7、V. parahaemolyticus和L. monocytogenes四種常見食源性致病菌作為考察對象。S. Typhimurium和四種非目標菌的濃度均為105 CFU mL-1。如圖所示,相較于空白對照,非目標菌引起的信號變化率均在5%以內,而目標物S. Typhimurium則可引起60%以上的信號下降,體現了該生物傳感器良好的特異性。
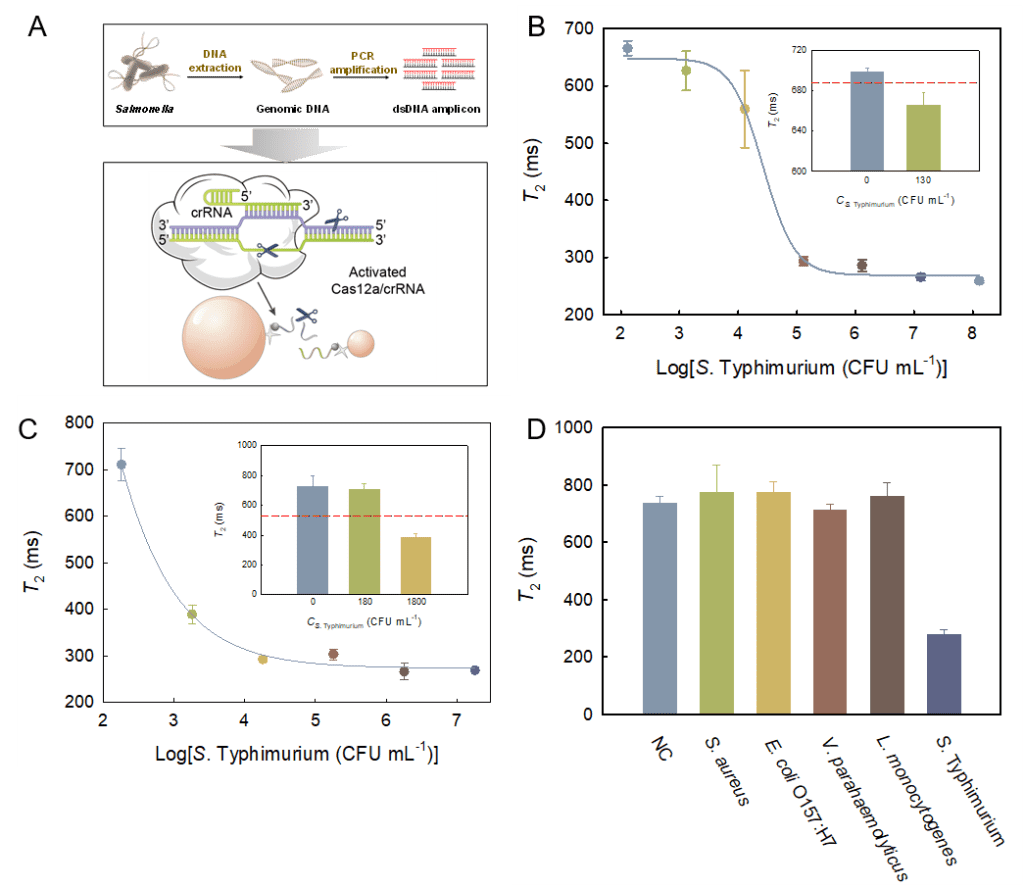
圖 4
本文提出了一種基于CRISPR-Cas12a系統的MRS生物傳感器檢測沙門氏菌。該方法利用CRISPR-Cas12a系統控制兩種不同粒徑MNPs的結合,并以游離的小粒徑MNPs為磁性探針實現MRS信號輸出,對純菌液和雞肉提取液加標樣品中S. Typhimurium的LOD分別為1.3×102 CFU mL-1和1.8×103 CFU mL-1。該方法充分利用了MNPs作為磁分離載體和信號標簽的雙重功能。此外,檢測磁分離后的清液省去了繁瑣的重復洗滌操作,簡化了檢測步驟。通過設計特定的crRNA,該方法亦可拓展至其他目標物的檢測,具備一定的通用性。
該研究工作得到了國家自然科學青年基金,沃爾瑪基金會和沃爾瑪食品安全協作中心的的資助與支持。

電話:400-060-3233
售后:400-060-3233


返回頂部