
核磁共振成像因其具有無創、快速、高解析率、高對比度等特點,在臨床上廣為使用。特別是在腫瘤的診斷中,該技術利用病變組織和正常組織物理特性的不同而獲得的結構、功能影像,已經成為原發腫瘤和腫瘤轉移早期診斷中不可或缺的重要依據。腫瘤的形成是長時間、多因素控制、多步驟、多基因突變的復雜變化過程。大多數惡性腫瘤都是單克隆起源,呈現無控制性生長。在臨床上,相當一部分患者尋求醫治時,疾病已經進入中、晚期,喪失了最佳的治療時間,這是腫瘤死亡率居高不下的原因之一。核磁共振成像雖然具備上述種種優點,但因其較低的靈敏度卻不能滿足腫瘤早期診斷的要求。這是因為,早期腫瘤和正常組織在物理特性上差異較小(例如T1和T2),這種微小的物理特性差異不足以產生腫瘤和正常組織的影像對比。為了解決這一難題,人們應用核磁共振造影劑來增強腫瘤和正常組織影像的對比度以利于腫瘤的早期診斷。
氫核的MRI信號是多種組織的MRI信號源,MRI造影劑不產生信號,它的作用在于改變組織內部氫核系統的弛豫時間。與周圍組織形成對比。MRI信號強度與物理和化學參數相關,如質子密度 自旋-晶格弛豫時間T1、自旋-自旋弛豫時間T2。T1、T2參數控制了成像的對比強度。在軟組織中氫質子密度變化很小,因此在診斷中使用T1加權成像、T2加權成像。造影劑的功能依賴于它在組織中的濃度及在組織中質子密度及運動情況。
MRI造影劑一定是磁性物質,能同氫核發生磁性的相互作用。造影劑主要是通過影響了T1、T2來改變信號強度。根據原理可將造影劑分為T1類制劑和T2類制劑。T1類制劑是在T1加權成像中增加信號的強度。T2類制劑在了T2加權成像中降低信號強度。臨床使用哪一類造影劑則根據組織的特點而定。T1縮短的過程要求氫質子與造影劑的磁性部分直接作用,即水分子的氫核要盡可能地接近磁性微粒達到弛豫增強。如脂質體包裹的Gd-DTPA其T1增強效果弱于相同濃度的Gd-DTPA,由于脂質體限制了外部水分子同Gd-DTPA的接近。T2縮短過程是一種遠程效應,通過T2制劑的局部磁環境的不均勻性干擾T2。將T2類制劑包入脂質體,其T2弛豫增強,因為脂質體的聚集產生了更大的局部磁環境的變化。
組織中T1、T2值與造影劑濃度的關系如下:
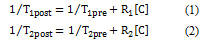
R1、R2為造影劑的弛豫速率,描述了造影劑對組織中T1、T2的影響,[c]為組織中均勻分布的造影劑的濃度。式(1)、(2)T1、T2的倒數同造影劑的濃度呈簡單的線性關系。R1、R2依賴于造影劑的結構,對于T1類制劑主要決于造影劑同水分子接近的情況,T2類制劑依賴于磁性物質的濃度。
1971年Damadian發現腫瘤組織中水分子質子的弛豫時間的T1、T2值比正常組織大,1978年Mallard,Hutchison及Lauterbur等用0.04T~0.085T的核磁共振設備取得了第1幅人體頭部、胸部和腹部的圖像。自此,核磁共振成像技術以無輻射損傷、無破壞性、無試劑侵入并能從分子水平到整體臟器系統地研究活體和動態過程等這樣一些突出的優點受到科學界的高度重視,發展相當迅速,使這一新的醫學影像診斷技術迅速地在各國的醫療中心和大中型醫院普及起來,成為臨床診斷的重要工具。
核磁共振成像診斷技術的原理主要是利用生物體不同組織中水質子在外磁場影響下產生不同的共振信號來成像,信號的強弱取決于組織內水的含量和水分子中質子的弛豫時間,可有效檢測組織壞死、局部缺血和各種惡性病變(如腫瘤),進行早期診斷。?
儀器使用小動物核磁共振成像系統,圖像為T1加權像橫斷面、冠狀面,采樣參數如下:FOV=100mm×100mm, TR=400ms, TE=19ms, 層厚3.5mm, 層間距1mm, 累加次數16, K空間大小192×256。成像結果顯示,注射造影劑后,大鼠心臟與肝臟變亮,且隨代謝時間延長逐漸變暗。
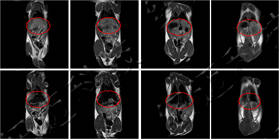
大鼠造影前后MRI冠狀面

大鼠體內造影劑代謝MRI橫斷面
電話:400-060-3233
售后:400-060-3233


返回頂部